Merit Medical HepaSphere Microspheres(With Doxorubicin) IFU-Int'l: /
/: Merit Medical HepaSphere Microspheres(With Doxorubicin) IFU-Int'l

• Přidejte nejméně 20 ml neiontové kontrastní látky do 30ml
Po dokončení rekonstituce skladujte roztok HepaSphere
stříkačky s obsahem doxorubicinu HCl v HepaSphere
mikrosfér při teplotě 2 až 8°C; POKUD ho nepoužijete
mikrosférách; větší objem roztoku však může zajistit vyšší
okamžitě, použijte ho do 24 hodin. Neskladujte HepaSphere
kontrolu během embolizace. Jemně obraťte stříkačku 2x nebo
mikrosféry po přidání kontrastní látky.
3x a počkejte 5 minut, dokud nebude roztok zcela
h
omogenní.
• Před každou injekcí zkontrolujte, že jsou v suspenzi kuličky.
Pokud ne, převraťte stříkačku tam a zpět, aby se obsah ve
s
tříkačce rozptýlil.
POKYNY PRO APLIKACI:
•
Pečlivě zkontrolujte vaskulární řečiště spojené s postiženým
místem pomocí zobrazení s vysokým rozlišením.
Poznámka:
Je důležité zjistit, zda jsou přítomny jakékoliv
arteriovenózní zkraty, a to před počátkem embolizace.
•
Za použití standardních technik umístěte aplikační katétr do
c
ílové cévy a konec katétru co nejblíže k cíli embolizace.
• Pro aplikaci HepaSphere mikrosfér s doxorubicinem použijte
injekční stříkačku s obsahem maximálně 3 ml. Doporučuje se
1ml injekční stříkačka.
• Natáhněte 1 ml směsi HepaSphere mikrosfér do injekční
stříkačky.
Informace na balení:
• Lze použít dvě metody pro izolaci embolického podílu při
aplikaci injekce:
- Možnost 1:
Na 30ml stříkačku s obsahem HepaSphere
Symbol Značení
mikrosfér s doxorubicinem napojte 3cestný uzavírací kohout
infuzního mikrokatétru a použijte 1ml stříkačku na injekci
Výrobce: Jméno a adresa
skrze otevřený port 3cestného uzavíracího kohoutu.
- Možnost 2:
Sériové alikvoty HepaSphere mikrosfér s
Použijte do: rok-měsíc
doxorubicinem lze natáhnout z 30ml stříkačky do 1ml injekční
stříkačky skrze 3cestný uzavírací kohout, který není připojen
na infuzní katétr. 1ml stříkačka s obsahem každého alikvotu
LOT
Kód šarže
může být připevněna nezávisle na infuzní mikrokatétr a
vstříknuta.
REF
Katalogové číslo
• Obraťte 30ml stříkačku vpřed a vzad pro uchování
homogenní suspenze směsi HepaSphere mikrosfér.
• Za stálé rentgenové monitorace vstřikujte alikvot
HepaSphere mikrosfér s doxorubicinem pomalým,
nenásilným a pulsačním způsobem po dobu přibližně
1 minuty na 1 ml roztoku mikrosfér. Vždy vstřikujte při volném
proudění krve a dohlédněte, aby nedošlo k refluxu.
Poznámka:
Reflux embolických sfér může způsobit
okamžitou ischémii necílených tkání a žil.
• Pokud dojde v přívodní stopce během aplikace HepaSphere
mikrosfér s doxorubicinem k městnání, vyčkejte nejméně
5 minut a poté proveďte selektivní angiografii; po uplynutí
celých 5 minut ověřte zastavení antegrádního toku.
• Pokud k zastavení antegrádního toku nedojde, pokračujte v
infuzi pod skiaskopickou kontrolou, dokud nedojde k
požadované devaskularizaci.
• Po dokončení infuze HepaSphere mikrosfér odstraňte
katétr, přičemž dále udržujte jemné odsávání, aby se předešlo
vytlačení zbytkových HepaSphere mikrosfér, které mohou být
stále v průsvitu katétru. Po odstranění katétr vyhoďte a znovu
ho nepoužívejte.
• Všechny otevřené lahvičky a nepoužité HepaSphere
mikrosféry vyhoďte.
UPOZORNĚNÍ:
Všechny vážné nebo životu nebezpečné nežádoucí příhody
Pokud se katétr ucpe nebo se během aplikace objeví značná
nebo úmrtí ve spojitosti s používáním mikrosfér HepaSphere
rezistence proti infuzi, nepokoušejte se propláchnout katétr
se musí hlásit výrobci prostředku.
nadměrným tlakem, může dojít k refluxu embolického
materiálu vedoucímu k necílené embolizaci. Za mírného
odsávaní katétr odstraňte a vyhoďte.
UDRŽOVÁNÍ A SKLADOVÁNÍ:
HepaSphere mikrosféry je nutné skladovat na suchém,
tmavém místě v originálních lahvičkách a balení. Použijte do
data vyznačeného na štítku krabičky a balení.
58
2
STERILIZE
Neresterilizujte
Nepoužívejte, pokud obal balení poškozený
Chraňte před slunečním světlem
Uchovávejte v suchu
2
730095003_A ID 102412_IFU HS DOXO :print 9/11/12 17:11 Page 58
Velikost suchého
Množství
B
arevný kód
p
roduktu
m
ikrosfér
O
dkaz (HS)
(okraje štítku)
(µm)
(mg)
25
V 225 HS
30-60 Oranžové
50
V 250 HS
25
V 325 HS
50-100 Žlutá
50
V 350 HS
2
5
V
525 HS
100-150 Modrá
50
V 550 HS
25
V 725 HS
150-200
Červená
50
V 750 HS
Nepoužívejte opakovaně
Upozornění – Viz návod k použití
Nepyrogenní
STERILE
R
Sterilizováno zářením
Logo označení CE –
Identifikace notifikované osoby : 0459
Velikost suchých mikrosfér / velikost
/
hydratovaných mikrosfér

730095003_A ID 102412_IFU HS DOXO :print 9/11/12 17:11 Page 59
POLSKI
P
R
ZEZNACZENIE:
n
ależy zachować ostrożność w czasie wykonywania wszelkich
Mikrosfery HepaSphere™ są przeznaczone do embolizacji naczyń
zabiegów obejmujących krążenie pozaczaszkowe w obrębie głowy i
krwionośnych z jednoczesnympodaniem HCl doksorubicyny lub bez
szyi lekarz powinien dokładnie rozważyć potencjalne korzyści
w
celachterapeutycznychlub przed operacją,w trakcie następujących
w
ykonania embolizacji względem zagrożeń i potencjalnych powikłań
procedur:
związanych z zabiegiem.Takie powikłania mogą obejmować ślepotę,
• Embolizacja raka z komórek wątrobowych
utratę słuchu, utratę węchu, paraliż i śmierć.
• Embolizacja przerzutów do wątroby.
• U pacjentów narażonych na długie okresy kontroli fluoroskopowej,
p
acjentów o większych rozmiarach ciała, w przypadku badań rtg
OPIS:
wykonywanych w projekcji skośnej, pobierania wielu obrazów lub
M
ikrosfery HepaSphere należą do rodziny materiałów
r
adiogramów może wystąpić poważne popromienne uszkodzenie
e
mbolizacyjnych opartych na zastrzeżonych technologiach. Są
s
kóry. Zapoznać się z protokołem klinicznym placówki, aby
przeznaczonedo kontrolowanej, celowanejembolizacji. Do mikrosfer
sprawdzić, czy dla każdego typu przeprowadzanej procedury jest
HepaSphere można wprowadzić HCl doksorubicyny i dzięki temu
stosowana odpowiednia dawka promieniowania.
mogą one lokalnie uwalniać lek w miejscu embolizacji. Mikrosfery
• Można opóźnić wystąpienie uszkodzeniapopromiennego u pacjenta.
HepaSphere to biokompatybilne, hydrofilowe, niewchłanialne,
Pacjenci powinni otrzymać informacjena tematpotencjalnychefektów
rozszerzalne i elastyczne mikrosfery. Mikrosfery HepaSphere
promieniowania,objawów, na które należy zwracaćuwagęi z kim się
pęcznieją w kontakcie z roztworami wodnymi. Są dostępne w wielu
skontaktować w przypadku ich wystąpienia.
rozmiarach.
• Mikrosfer HepaSphere NIEWOLNO rozcieńczać sterylną wodą do
iniekcji. W wyniku rozcieńczenia w sterylnej wodzie mikrosfery
Stan suchy (μm)
HepaSpherezbytnio spęcznieją i ich iniekcja będziebardzo trudna lub
nawet niemożliwa.
30-60
• Nie rozpuszczać mikrosfer HepaSphere w preparacie Lipiodol /
50-100
Ethiodol.
• Należy zwrócić bacznąuwagę nawszelkieoznakiembolizacjimiejsc
100-150
zdrowych. W czasie iniekcji należy uważnie monitorować parametry
150-200
życiowe pacjenta, aby ocenić SAO2 (np. niedotlenienie, zmiany
OUN). Należy rozważyć zakończenieprocedury, ocenęewentualnego
OPAKOWANIE PRODUKTU:
przecieku lub zastosowanie większych cząstek, jeżeli wystąpią
MikrosferyHepaSpheresą dostarczane wsterylnejfiolceo pojemności
jakiekolwiek oznaki przejścia mikrosfer poza miejsce docelowe lub
10 ml, wykonanej z cyklicznego kopolimeru olefinowego (COC) i
objawy u pacjenta.
zamkniętej kapslem, znajdującej się w zamkniętym woreczku.
• Należy rozważyć zastosowanie mikrosfer o większej średnicy, jeżeli
Zawartość: 25 mglub 50 mg suchych mikrosferHepaSphere na fiolkę,
w odpowiednim czasiebrakjest naangiogramiedowodów embolizacji
do rekonstytucji przed użyciem.
w czasie wprowadzania mikrosfer.
PRZECIWWSKAZANIA:
• Pacjenci nietolerujący procedur zamykania naczyń
Ostrzeżenia związane ze stosowaniem małych mikrosfer:
• Budowa anatomiczna naczyń lub przepływ krwi uniemożliwiające
• Należy zachować ostrożność w sytuacji, gdy planowane jest
prawidłowe umieszczenie cewnika lub wykonanie iniekcji czynnika
zastosowanie czynników embolizacyjnych o średnicy mniejszej niż
embolizacyjnego
zdolność rozdzielcza aparatu do obrazowania. Obecność zespoleń
• Obecność lub podejrzenie skurczu naczyń
tętniczo-żylnych,naczyń rozgałęziających się od miejsca docelowego
• Obecność krwotoku lub jego prawdopodobne rozpoczęcie
lub nowych naczyń niewidocznych przed embolizacją może
• Obecność poważnej miażdżycy naczyń
prowadzić do embolizacji niepożądanego obszaru i poważnych
• Zbyt małe tętnice zasilające dla wybranych mikrosfer HepaSphere
powikłań.
• Obecność naczyń obocznych, które potencjalnie mogą powodować
• Mikrosfery o średnicy mniejszej niż 100 mikronów będą zwykle
zagrożenie na zdrowym obszarze w czasie embolizacji
migrować do obszarów dystalnych względem naczyń zasilających
• Przecieki tętniczo-żylne lub przetoki o wysokim przepływie lub o
zespolenia i dlatego istnieje większe prawdopodobieństwo, że
średnicy większej niż wybrane mikrosfery HepaSphere
zablokują krążenie w tkankach dystalnych. Większe
• Opór naczyń obwodowych względem tętnic zasilających
prawdopodobieństwo wystąpienia urazu niedokrwiennego jest
uniemożliwiający przejście mikrosfer HepaSphere do zmiany
związane z zastosowaniem mikrosfer o mniejszej wielkości i przed
• Tętnice zasilające zmianę są zbyt małe dla mikrosfer HepaSphere
embolizacją należy rozważyć konsekwencje takiego urazu.
• Nie stosować w naczyniach płucnych, wieńcowych i ośrodkowego
Potencjalne konsekwencjeobejmująobrzęk, martwicę,paraliż,ropnie
układu nerwowego
i/lub bardziej poważny zespół poembolizacyjny.
• Znane uczulenie na poli(akrylany winylowo-sodowe)
• Obrzęk poembolizacyjny może spowodować wystąpienie
niedokrwienia tkanek blisko obszaru docelowego. Należy zachować
OSTRZEŻENIA:
ostrożność, aby uniknąć niedokrwienia tkanek zdrowych,
• Wielkość mikrosfer HepaSphere należy dobrać, uwzględniając
nietolerujących takiego stanu, jak np. tkanka nerwowa.
wygląd tętnic i żył na angiogramie. Wielkość mikrosfer HepaSphere
należy dobrać tak, aby uniknąć przejścia z tętnicy do żyły.
ŚRODKI OSTROŻNOŚCI:
• Niektóre Mikrosfery HepaSphere mogą mieć rozmiar nieznacznie
Mikrosfery HepaSphere powinny być podawane wyłącznie przez
poza podanymzakresem.Z tegowzględu lekarz musi starannie dobrać
lekarzy posiadających przeszkolenie w procedurach embolizacji
rozmiar Mikrosfer HepaSphere w zależności od rozmiaru naczyń
naczyń. Wielkość i ilość mikrosfer należy uważnie dobrać w
docelowychoraz żądanego poziomuokluzji w układzie naczyniowym,
zależności od zmiany, która ma być leczona i od tego, czy są obecne
biorąc pod uwagę angiograficzną ocenę żył i tętnic.
przecieki. Jedynie lekarz może określić najbardziej odpowiedni czas
• Ze względu na poważne powikłania nieprawidłowej embolizacji
przerwania iniekcji mikrosfer HepaSphere.
59
730095003_A ID 102412_IFU HS DOXO :print 9/11/12 17:11 Page 60
Nie stosować, jeżeli fiolka, zatyczka lub woreczek wydają się
• Infekcja wymagająca interwencji medycznej
uszkodzone.
• Powikłania związane z cewnikowaniem (np. krwiak w miejscu
D
o użytku u jednego pacjenta - Zawartość dostarczona w postaci
w
ejścia prowadzenia cewnika, powstanie skrzepu na końcu cewnika
s
terylnej - Nigdy nie stosować ponownie, nie przetwarzać ponownie
i
jego późniejsze oderwanie oraz urazy nerwów i/lub naczyń, które
a
ni nie sterylizować ponownie zawartości fiolki, która została
m
ogą skutkować urazem kończyn dolnych)
w
cześniej otworzona. Ponowne stosowanie, ponowna obróbka lub
•
Reakcja alergiczna na leki (np. na leki przeciwbólowe)
s
terylizacja mogą niekorzystnie wpłynąć na strukturalną integralność
•
Reakcja alergiczna na niejonowe środki kontrastowe lub materiał
p
roduktu lub mogą prowadzić do uszkodzenia produktu, co z kolei
e
mbolizacyjny
m
oże skutkować urazem pacjenta, chorobą lub zgonem. Ponowne
•
Pęknięcie naczynia lub zmiany oraz krwotok
s
tosowanie, ponowna obróbka lub sterylizacja mogą ponadto
•
Zgon
s
twarzaćzagrożenie skażenia urządzenia lub spowodować zakażenie
•
Dodatkowe informacje podano w części Ostrzeżenia
p
acjenta lub zakażenie krzyżowe, co między innymi obejmuje
p
rzeniesienie choroby (chorób) zakaźnej (zakaźnych) między
P
ĘCZNIENIE:
p
acjentami. Skażenie produktu może prowadzić do urazu, choroby
M
ikrosfery HepaSphere pęczniejąw czasierekonstytucjiw wodnym
l
ub zgonu pacjenta. Wszystkie procedury należy wykonywać,
r
oztworze 0,9% NaCl i niejonowych środkach kontrastowych. W
s
tosując zatwierdzoną metodę aseptyczną.
p
rzypadku wprowadzenia do 100% wodnego roztworu 0,9% NaCl
l
ub niejonowego środkakontrastowegoalbo mieszaninyzawierającej
50% niejonowego środka kontrastowego i 50% wodnego roztworu
MikrosferHepaSphere NIE WOLNO stosować w suchymstanie
0,9% NaCl mikrosferyHepaSphere zwiększająśrednicęokoło4 razy
podstawowym.Przed użyciem należy je rozpuścić. Mikrosfery
w porównaniu z ich średnicą w suchym stanie podstawowym w
HepaSphere pęcznieją w kontakcie z roztworami wodnymi. Stopień
przeciągu około 10 minut. Na przykład, mikrosfery HepaSphere o
pęcznienia zależy od stężenia jonów w roztworze. Mikrosfery
średnicy około 50-100 mikronów w suchym stanie podstawowym
zwiększają swojąśrednicę około czterech razy w wodnym roztworze
zwiększą średnicę do około 200-400 mikronów w czasie
0,9% NaCl oraz w niejonowych środkach kontrastowych, w
rekonstytucji, jakprzedstawiono poniżej. Ze względu nawewnętrzną
porównaniu z ich średnicą w stanie suchym. Stopień zwiększenia
zmienność procesu pęcznienia po rekonstytucji niektóre mikrosfery
średnicy po wprowadzeniu HCl doksorubicyny zależy od ilości
HepaSphere będą mieć wielkość nieco przekraczającą ten zakres,
wprowadzonego leku. Liofilizowany HCl doksorubicyny należy
dlatego lekarz powinien uważnie dobrać wielkość mikrosfer
rozpuścić w roztworze 0,9% NaCl. Mikrosfery HepaSphere nieco
HepaSphere do wielkości naczyń docelowych przy pożądanym
zmniejszają wielkość o około 20% po wprowadzeniu do nich HCl
poziomie zamknięcia naczynia i do charakteru roztworu wodnego.
doksorubicyny w porównaniu z ich wielkością w czystym roztworze
Informacja:
Aby mikrosfery HepaSphere prawidłowo zwiększyły
wodnym 0,9% NaCl. Mikrosfery HepaSphere są ściśliwe i można je
swoją objętość, należyje rozpuszczać w conajmniej 10ml roztworu.
łatwo wprowadzać przez mikrocewniki. Niemniej jednak, jeżeli
Stopień zwiększenia średnicy po wprowadzeniu HCl doksorubicyny
mikrosfery HepaSphere zostaną podane w iniekcji przed
zależy odilości wprowadzonego leku.Mikrosfery HepaSphere nieco
osiągnięciem przez nie docelowej wielkości, mogą nie dotrzeć do
zmniejszają wielkość o około 20% po wprowadzeniu do nich HCl
planowanego miejsca embolizacji lub spowodować embolizację
doksorubicyny w porównaniu z ich wielkością w czystym roztworze
większego obszaru tkanek.
wodnym 0,9% NaCl.
Informacja:
Maksymalne zalecane stężenie HCl doksorubicyny
wynosi 5 mg/ml. Stężenie HCl doksorubicyny powyżej
KOMPATYBILNOŚĆ Z CEWNIKAMI:
5 mg/ml istotnie zwiększa lepkość roztworu i utrudnia postępowanie
Mikrosfery HepaSphere można wprowadzać, stosując mikrocewniki
z mikrosferami HepaSphere.
o następujących specyfikacjach:
Pacjenci, u którychstwierdza się znane uczulenia naniejonoweśrodki
kontrastowe, mogą wymagać podania kortykosteroidów przed
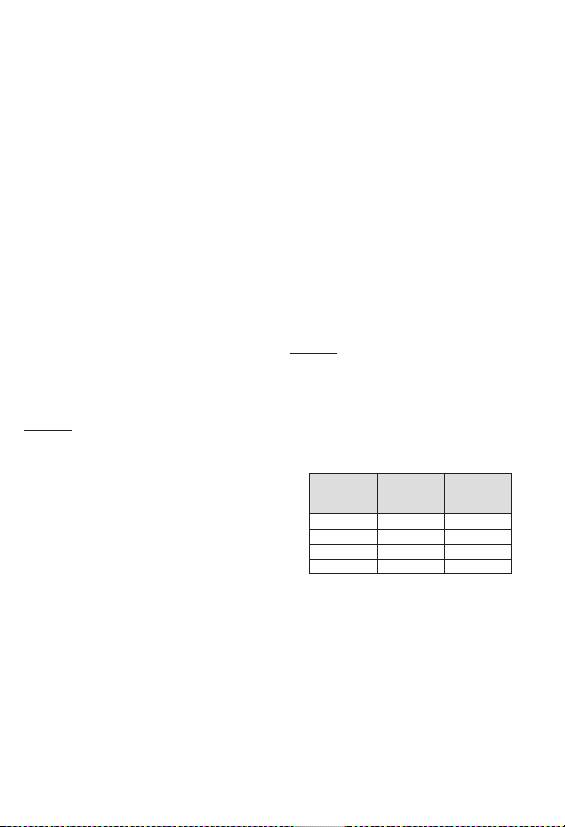
Przybliżony zakres
Stan suchy
Wielkość cewnika
embolizacją.
wielkości po
(μm)
śr. wew. (in.)
Dodatkowe oceny lub środki ostrożności mogą być konieczne w
rekonstytucji (μm)
trakcie opieki okołozabiegowej w przypadku pacjentów z
30-60 120 - 240
≥ 0.021
następującymi schorzeniami:
• Skaza krwotoczna lub stan nadkrzepliwości
50-100 200 - 400
≥ 0.021
• Obniżenie odporności
100-150 400 - 600
≥ 0.024
150-200 600 - 800
≥ 0.027
MOŻLIWE POWIKŁANIA:
Embolizacja naczyń jest procedurą o wysokim ryzyku. Powikłania
mogąwystąpić w dowolnym czasie w trakcie procedury lub po niej i
INSTRUKCJE:
między innymi mogą obejmować:
Mikrosfery HepaSphere należy rozpuścić w 100% roztworze
• Paraliż związany z embolizacją w innym miejscu niż docelowe lub
wodnym 0,9% NaCl lub niejonowym środku kontrastowym albo w
urazem niedokrwiennym w wyniku obrzęku sąsiadujących tkanek
mieszaninie zawierającej 50% niejonowego środka kontrastowego i
• Niepożądany przepływ wsteczny lub przejście mikrosfer
50% wodnegoroztworu 0,9%NaCl w przypadkustosowania bez HCl
HepaSphere do zdrowych tętnic blisko zmiany docelowej lub przez
doksorubicyny lub wprowadzić do nich roztwór HCl doksorubicyny
zmianę do innych tętnic lub łożysk tętniczych, takich jak np. tętnica
przed ułożeniem cewnika.
szyjna wewnętrzna, krążenie płucne lub wieńcowe.
• Wielkość mikrosfer HepaSphere należy uważnie dobrać do
• Zator tętnicy płucnej z powodu przecieku tętniczo-żylnego
wielkościnaczyń docelowych przy pożądanympoziomiezamknięcia
• Niedokrwienie w niepożądanym miejscu w tym udar
naczynia i do charakteru roztworu wodnego. Patrz opis
niedokrwienny, zawał niedokrwienny (w tym zawał mięśnia
„PĘCZNIENIE”.
sercowego) i martwica tkanek
• Mikrosfery HepaSphere mogą być obecne poza fiolką. Dlatego z
• Niedrożność łożyska naczyń włosowatych i uszkodzenie tkanek
fiolką należysię obchodzić w taki sposób, abyzachowaćaseptykę,w
• Skurcz naczyń
pewnej odległości od głównego pola operacyjnego.
• Rekanalizacja
• Należy upewnić się, że mikrosfery HepaSphere są kompatybilne z
• Ślepota, utrata słuchu i utrata węchu
cewnikiem o wielkości, która ma zostać zastosowana. Patrz tabela
• Reakcje na ciało obce wymagające interwencji medycznej
powyżej.
60

730095003_A ID 102412_IFU HS DOXO :print 9/11/12 17:11 Page 61
• Wizualnie ocenić opakowanie, aby potwierdzić, że nie zostało
OPCJA 2: PRZYGOTOWANIE DO EMBOLIZACJI Z HCl
naruszone.Wyjąć fiolkę z woreczka. Zewnętrzna powierzchniafiolki
DOKSORUBICYNY
j
est sterylna.
OSTRZEŻENIE:
Liposomalne preparaty HCl doksorubicyny nie są odpowiednie do
MIKROSFERY HEPASPHERE MOŻNASTOSOWAĆ Z HCL
w
prowadzania do mikrosfer HepaSphere.
DOKSORUBICYNY LUB BEZ.
W typowej sytuacji wprowadzenie liofilizowanego HCl
doksorubicyny rozpuszczonego w roztworze 0,9% NaCldo mikrosfer
OPCJA1: PRZYGOTOWANIE DO EMBOLIZACJI BEZ HCl
H
epaSphere trwa około godziny. Mikrosfer HepaSphere nie należy
DOKSORUBICYNY
stosować, jeżeli nie są w pełni uwodnione i spęczniałe. Kinetyka
P
rzybliżony czas rekonstytucji w przypadku stosowania mikrosfer
wprowadzania rozpuszczalnego HCI doksorubicyny do mikrosfer
bez HCl doksorubicyny wynosi 10 min.
p
rzebiega różnie, zależnie od stężenia i pH roztworu.
• Należy wybrać odpowiednią dawkę HCl doksorubicyny do
•
Napełnić 10 ml strzykawkę 100% wodnym roztworem 0,9% NaCl
wprowadzenia do mikrosfer HepaSphere.
lub niejonowym środkiem kontrastowym (albo mieszaniną
Informacja:
Do każdej fiolki zawierającej mikrosfery HepaSphere
zawierającą 50% wodnego roztworu 0,9% NaCl i 50% środka
można wprowadzić maksymalną dawkę HCl doksorubicyny
kontrastowego).Podłączyć strzykawkę doigłyo średnicyco najmniej
wynoszącą 75mg. Rozpuścić wymaganądawkę liofilizowanego HCl
20 G.
doksorubicyny w 20 ml
roztworu do iniekcji zawierającego 0,9%
• Aby zapewnić odpowiednią rekonstytucję mikrosfer HepaSphere,
NaCl. NIGDY NIE STOSOWAĆ CZYSTEJ WODY
należy palcami chwycić fiolkę poziomo i kilka razy obrócić. Dzięki
Informacja: Maksymalne zalecane stężenie HCl doksorubicyny
temu sucha zawartość fiolki osiądzie na ściankach.
wynosi 5 mg/ml. Stężenie HCl doksorubicyny powyżej
Informacja:
Odsunąć odchylaną zatyczkę; nie usuwać kapsla ani
5 mg/ml istotnie zwiększa lepkość roztworu i utrudnia postępowanie
korka z fiolki.
z mikrosferami HepaSphere.
• Ostrożnie przebić igłę nasadzoną na strzykawkę przez korek fiolki.
• Pobrać 20 ml roztworu HCl doksorubicyny do dwóch osobnych
Nadal obrać fiolkę między palcami i wprowadzić pełną objętość
strzykawek 30 ml. Każda 30 ml strzykawkapowinna zawierać10 ml
(10 ml) roztworu do rekonstytucji do fiolki, a następnie umieścić
roztworu HCl doksorubicyny.
fiolkę pionowo i ostrożnie usunąć strzykawkę z dołączoną igłą.
• Podłączyć jedną 30ml strzykawkę zawierającą 10ml roztworu HCl
Informacja:
Fiolka jest hermetycznie zamknięta. Aby ułatwić
doksorubicyny do igły o średnicy co najmniej 20 G.
iniekcję roztworu do rekonstytucji do fiolki, można zastosować
• Aby zapewnić odpowiednią rekonstytucję mikrosfer HepaSphere,
odpowiednie metody aspiracji i/lub odpowietrzania, zgodnie z
należy palcami chwycić fiolkę z mikrosferami HepaSphere poziomo
zasadami danej placówki zdrowia. Jeżeli przedrekonstytucją z fiolki
i kilka razy obrócić. Dzięki temu sucha zawartość fiolki osiądzie na
będzie usuwane powietrze, należy zachować ostrożność, aby nie
ściankach.
usunąć mikrosfer z fiolki.
Informacja:
Odsunąć odchylaną zatyczkę; nie usuwać kapsla ani
• W celu zapewnienia równomiernej rekonstytucji mikrosfer
korka z fiolki.
HepaSphere należy delikatnie odwrócić fiolkę tak, aby płyn miał
• Ostrożnie włożyć igłę jednej z dwóch 30 ml strzykawek
przez 5-10 razy kontakt z korkiem.
zawierających 10ml roztworu HCl doksorubicyny przezkorekfiolki.
Informacja:
W wyniku mocnego potrząsania mogą zostać
Nadal rolować fiolkę między palcami i wprowadzić całą objętość 10
wprowadzone mikropęcherzyki, co może prowadzić do agregacji
ml roztworu HCl doksorubicyny do fiolki.
mikrosfer.
• Postawić fiolkę z mikrosferami HepaSphere pionowo. Ostrożnie
• Należy odczekać conajmniej 10 minut
, aby mikrosfery HepaSphere
zdjąćstrzykawkęz dołączoną igłą i postawić fiolkę w pozycji stojącej
rozpuściły się i odpowiednio spęczniały.
przez 10 minut, aby całkowicie uwodnić mikrosfery.
• Do aspiracji zawartości fiolki zastosować30 ml strzykawkę i igłę o
• W ciągu 10-minutowego okresu nawadniania potrząsnąć fiolkę z
wielkości co najmniej 20 G. Obrócić fiolkę do położenia pionowego
mikrosferami HepaSphere kilka razy, aby płyn zetknął się z szarym
tak, aby dno fiolki było skierowane do góry. Odciągnąć igłę tak, aby
korkiem. Powtarzać ten proces co 2-3 minuty, aby zapewnić
nadal była zanurzona w płynie, ale nie była blokowana przez korek.
równomierną rekonstytucję mikrosfer HepaSphere.
Delikatnie przenieść całą zawartość fiolki do strzykawki.
Informacja:
Fiolka jest hermetycznie zamknięta. Aby ułatwić
Informacja:
Jeżeli wcześniej z fiolki usunięto powietrze, należy za
iniekcję roztworów do rekonstytucji do fiolki, można zastosować
pomocą strzykawki delikatnie wprowadzić powietrze przed aspiracją
odpowiednie metody aspiracji i/lub odpowietrzania, zgodnie z
zawartościfiolki,abyumożliwić łatwiejsząaspiracjęzawartości fiolki
zasadami danej placówki zdrowia. Jeżeli przedrekonstytucją z fiolki
do strzykawki. Jeżeli całość fiolki nie zostanie pobrana, wprowadzić
będzie usuwane powietrze, należy zachować ostrożność, aby nie
dodatkową objętość powietrza i powtórzyć proces aspiracji. Można
usunąć mikrosfer z fiolki.
dodaćwiększąilośćniejonowego środka kontrastowego lub roztworu
• Po 10minutach nawadniania podłączyć igłę owielkości co najmniej
wodnego 0,9% NaCl do strzykawki, aby uzyskać większe
20 G do drugiej 30 ml strzykawki zawierającej pozostałe 10 ml
rozproszenie mikrosfer.
roztworu HCl doksorubicyny i wprowadzić do fiolki z mikrosferami
Informacja:
Mikrosfery HepaSphere poddane rekonstytucji w
HepaSphere.Pobraćzawartośćfiolki z mikrosferamiHepaSphere do
sposób opisany powyżej można stosować w obecności leków
30 ml strzykawki zawierającej pozostałe 10 ml roztworu HCl
chemioterapeutycznych, takich jak cisplatyna, epirubicyna, HCl
doksorubicyny. Obrócić fiolkę do położenia pionowego tak, aby dno
doksorubicyny, fluorouracyl, irinotekan i mitomycyna po
fiolki było skierowane do góry. Odciągnąć igłę tak, aby nadal była
uwodnieniu. Niemniej jednak w celu dostarczania leku, mikrosfery
zanurzona w płynie, ale nie była blokowana przez korek. Delikatnie
HepaSphere są przeznaczone do stosowania tylko z HCl
przenieść całą zawartość fiolki do strzykawki.
doksorubicyny (patrz poniżej Opcja 2).
• Przed wyjęciem igły z fiolki z mikrosferami HepaSphere i nadal
• Jeżeli mikrosfery zostały rekonstytuowane za pomocą 100% 0,9%
trzymającstrzykawkę pionowo, delikatnie pociągnąćtłok strzykawki
NaCl, konieczne jest dodanie niejonowego środka kontrastowego do
w dół, usuwając wszelkie pozostałości roztworu, które mogą się
strzykawki zawierającej Mikrosfery HepaSphere w celu
znajdować w obudowie igły.
umożliwienia wizualizacji fluoroskopowej. Jeżeli do rekonstytucji
• Zamiast igły nałożyć zatyczkę strzykawki i kilka razy odwrócić
mikrosfer użyto niejonowego środka kontrastowego, można dodać
strzykawkę do góry i na dół, aby równo wymieszać jej zawartość.
dodatkowy niejonowy środek kontrastowy.
Odczekać co najmniej 60 minut, aby mikrosfery HepaSphere uległy
odpowiedniemu spęcznieniu, a HCl doksorubicyny przeszedł do ich
61

